Los compuestos organicos son muy importantes en nuestra vida diaria aunque no nos demos cuenta de ello debido a la importancia de los compuestos que contienen carbono. Los compuestos orgánicos son los componentes principales de los seres vivos y la vida como la conocemos no podría existir sin ellos
por ejemplo los alimentos. El alimento que ingerimos esta constituido por compuestos orgánicos. Los combustibles que utilizamos para mover los automóviles y calentar las casas son principalmente compuestos orgánicos. Una gran proporción de nuestras posesiones son total o parcialmente compuestos orgánicos. Por ejemplo, los plásticos que corresponden a un diverso grupo de compuestos orgánicos forman parte de la mayoría de los artículos que compramos.
jueves, 21 de junio de 2012
Aminas
Se pueden considerar compuestos derivados del amoníaco (NH3) al
sustituir uno, dos o tres de sus hidrógenos por radicales alquílicos o
aromáticos. Según el número de hidrógenos que se sustituyan se denominan aminas
primarias, secundarias o terciarias.
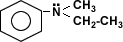
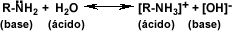
propiedades fisicas:
Las aminas son compuestos incoloros que se oxidan con facilidad lo que permite
que se encuentren como compuestos coloreados. Los primeros miembros de esta
serie son gases con olor similar al amoníaco. A medida que aumenta el número de
átomos de carbono en la molécula, el olor se hace similar al del pescado. Las
aminas aromáticas son muy tóxicas se absorben a través de la piel
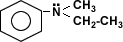
propiedades quimicas:
Las aminas se comportan como bases. Cuando una amina se disuelve en agua, acepta
un protón formando un ión alquil-amonio
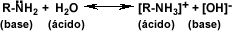
usos de las aminas:
tienen como principal función ser bases, las cuales pueden ser alifáticas y aromáticas, siendo las alifáticas las más básicas, ya que las aromáticas pueden resonar, deslocalizando el par electrónico del nitrógeno, haciéndo que sea menos probable la reacción ácido-base, un ejemplo de amina aromática es la Anilina, Un grupo amino (NH2) con un fenil unido al nitrógeno.
En lo que es la estructura química, la amina reacciona con un ácido carboxílico, formando una amida CONH2 junto con la eliminación de una molécula de agua, esta rección es la que forma el enlce peptídico, el cual se forma por la interacción de la cola y la base de un aminoácido, para formar un dipétptido, polipéptido y así sucesivamente.
En lo que es la estructura química, la amina reacciona con un ácido carboxílico, formando una amida CONH2 junto con la eliminación de una molécula de agua, esta rección es la que forma el enlce peptídico, el cual se forma por la interacción de la cola y la base de un aminoácido, para formar un dipétptido, polipéptido y así sucesivamente.
También las aminas como compuestos son muy importantes y reconocidas en industrias como las cosméticas y textiles por el uso o aplicación de la p-Fenilendiamina y algunos derivados se usan en composiciones para teñir el pelo y como antioxidantes para caucho.


Esteres
Los ésteres se forman por reacción entre un ácido y un alcohol. La reacción se produce con pérdida de agua. Se ha determinado que el agua se forma a partir del OH del ácido y el H del alcohol. Este proceso se llama esterificación.
Pueden provenir de ácidos alifáticos o aromáticos.
Se nombran como sales, reemplazando la terminación de los ácidos por oato seguido del nombre del radical del alcohol.

Propiedades físicas:
Los de bajo peso molar son líquidos de olor agradable, similar al de la esencia de las frutas que los contienen. Los ésteres de ácidos superiores son sólidos cristalinos, inodoros. solubles en solventes orgánicos e insolubles en agua. Su densidad es menor que la del agua.
propiedades químicas:
Hidrólisis ácida:
Por calentamiento con agua se descompone en el alcohol y el ácido de los que proviene.
éster + agua ------------- ácido + alcohol
Con un exceso de agua la reacción es total. Es un proceso inverso a la esterificación.
CH3.CO.O.CH3 + H2O ------------ CH3.CO.OH + H.CH2.OH
En presencia de un hidróxido y con exceso de agua y calor, se produce una reacción que da como productos el alcohol y la sal del ácido del que proviene. Esta sal es el jabón lo que da el nombre a la reacción.
éster + hidróxido -------------- sal de ácido + alcohol.
Usos
Formiato de etilo: esencia de grosella, ron
Acetato de etilo: esencia de manzana y pera. Solvente de la nitrocelulosa.
Butirato de etilo: esencia de durazno.
Acetato de butilo: solvente de la nitrocelulosa. Lacas; barnices; plásticos; vidrios de seguridad; perfumes.
Acetato de amilo: solvente de lacas y barnices
etil metanoato: olor a frambuesa
* pentil etanoato: olor a plátano
* pentil pentanoato: olor a manzana
* pentil butanoato: olor a pera o a albaricoque
* octil etanoato: olor a naranja.


Pueden provenir de ácidos alifáticos o aromáticos.
Se nombran como sales, reemplazando la terminación de los ácidos por oato seguido del nombre del radical del alcohol.

Propiedades físicas:
Los de bajo peso molar son líquidos de olor agradable, similar al de la esencia de las frutas que los contienen. Los ésteres de ácidos superiores son sólidos cristalinos, inodoros. solubles en solventes orgánicos e insolubles en agua. Su densidad es menor que la del agua.
propiedades químicas:
Hidrólisis ácida:
Por calentamiento con agua se descompone en el alcohol y el ácido de los que proviene.
éster + agua ------------- ácido + alcohol
Con un exceso de agua la reacción es total. Es un proceso inverso a la esterificación.
CH3.CO.O.CH3 + H2O ------------ CH3.CO.OH + H.CH2.OH
En presencia de un hidróxido y con exceso de agua y calor, se produce una reacción que da como productos el alcohol y la sal del ácido del que proviene. Esta sal es el jabón lo que da el nombre a la reacción.
éster + hidróxido -------------- sal de ácido + alcohol.
Usos
Formiato de etilo: esencia de grosella, ron
Acetato de etilo: esencia de manzana y pera. Solvente de la nitrocelulosa.
Butirato de etilo: esencia de durazno.
Acetato de butilo: solvente de la nitrocelulosa. Lacas; barnices; plásticos; vidrios de seguridad; perfumes.
Acetato de amilo: solvente de lacas y barnices
etil metanoato: olor a frambuesa
* pentil etanoato: olor a plátano
* pentil pentanoato: olor a manzana
* pentil butanoato: olor a pera o a albaricoque
* octil etanoato: olor a naranja.


Ácidos
Un ácido se considera cualquier compuesto quimico que al ser disuelto en agua produce una salución con una actividad de cation hidronio mayor que el agua pura. esto es un pH menor que 7. Según Lewis, ácido es toda molécula, radical o ion, que puede aceptar uno o varios electrones. También es ácido todo compuesto capaz de ceder protones.

Algunas propiedades de los ácidos:
son corrosivos
producen quemaduras en la piel
tienen un sabor ácido
en disoluciones acuosas son buenos conductores de electricidad
usos de los acidos en la vida:
algunos de los acidos juegan un importante papel en los seres vivos. por ejemplo el acido carbonico es fundamental en mantener constante del pH de la sangre; el ácido láctico y el ácido butanoico que estan presentes en la leche y en la mantequilla se forman por la acción bacteriana sobre los hidratos de carbono
algunos acidos también se emplean como conservadores de alimentos ya que la acción bacteriana sobre los mismos no se produce a Ph bajo


Algunas propiedades de los ácidos:
son corrosivos
producen quemaduras en la piel
tienen un sabor ácido
en disoluciones acuosas son buenos conductores de electricidad
usos de los acidos en la vida:
algunos de los acidos juegan un importante papel en los seres vivos. por ejemplo el acido carbonico es fundamental en mantener constante del pH de la sangre; el ácido láctico y el ácido butanoico que estan presentes en la leche y en la mantequilla se forman por la acción bacteriana sobre los hidratos de carbono
algunos acidos también se emplean como conservadores de alimentos ya que la acción bacteriana sobre los mismos no se produce a Ph bajo

miércoles, 20 de junio de 2012
Cetona
Una cetona es un compuesto orgánico caracterizado por poseer un grupo funcional carbonilo unido a dos átomos de carbono, a diferencia de un aldehído, en donde el grupo carbonilo se encuentra unido al menos a un átomo de hidrógeno. Cuando el grupo funcional carbonilo es el de mayor relevancia en dicho compuesto orgánico, las cetonas se nombran agregando el sufijo -ona al hidrocarburo del cual provienen (hexano, hexanona; heptano, heptanona; etc). También se puede nombrar posponiendo cetona a los radicales a los cuales está unido (por ejemplo: metilfenil cetona). Cuando el grupo carbonilo no es el grupo prioritario, se utiliza el prefijo oxo- (ejemplo: 2-oxopropanal).
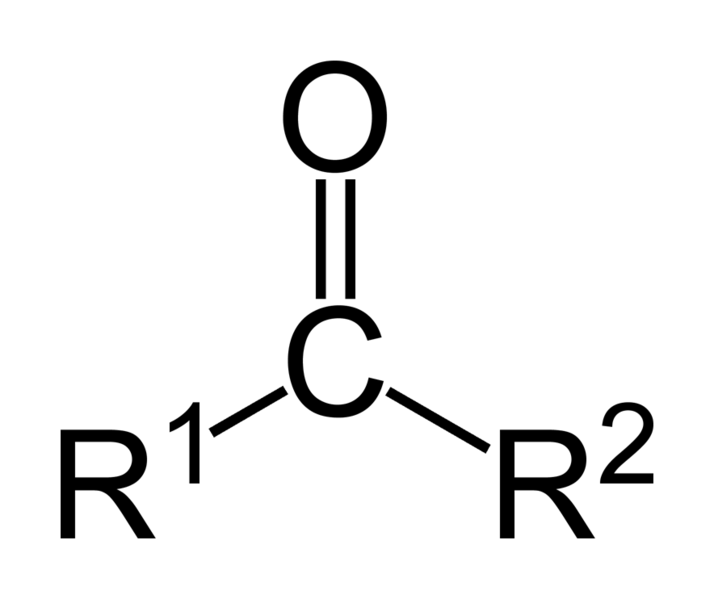
El grupo funcional carbonilo consiste en un átomo de carbono unido con un doble enlace covalente a un átomo de oxígeno. El tener dos átomos de carbono unidos al grupo carbonilo, es lo que lo diferencia de los ácidos carboxílicos, aldehídos, ésteres. El doble enlace con el oxígeno, es lo que lo diferencia de los alcoholes y éteres. Las cetonas suelen ser menos reactivas que los aldehídos dado que los grupos alquílicos actúan como dadores de electrones por efecto inductivo.

Ejemplos:
Aldehídos
Los aldehídos constituyen una clase de sustancias orgánicas que presentan el grupo funcional carbonilo dentro de la estructura de la molécula, acoplado a por lo menos un átomo de hidrógeno. Pueden ser alifáticos o aromáticos en dependencia de si el grupo funcional se acopla a un radical alquilo (R) o arilo (Ar) respectivamente, por el otro enlace disponible.

Aldehído aromático
El primer miembro de la clase de los aldehídos alifáticos es el formaldehído (CH2O), y es el único que posee dos átomos de carbono acoplados al grupo carbonilo. Esta diferencia estructural hace que tenga ciertas características que lo distinguen del resto de la clase. El segundo miembro se llama acetaldehído (CH3CHO) de estructura.

En los aldehídos aromáticos el primer miembro es el benzaldehído, con un anillo bencénico acoplado al grupo carbonilo.

Fuentes naturales y usos de los aldehídos.Los aldehídos están ampliamente presentes en la naturaleza. El importante carbohidrato glucosa, es un polihidroxialdehído. La vanillina, saborizante principal de la vainilla es otro ejemplo de aldehído natural. Probablemente desde el punto de vista industrial el mas importante de los aldehídos sea el formaldehído, un gas de olor picante y medianamente tóxico, que se usa en grandes cantidades para la producción de plásticos termoestables como la bakelita. La solución acuosa de formaldehído se conoce como formol o formalina y se usa ampliamete como desinfectante, en la industria textil y como preservador de tejidos a la descomposición.
Alcoholes.
Un alcohol es un compuesto orgánico en el que el grupo funcional hidroxilo (-OH) está enlazado a un átomo de carbono. En particular, este centro de carbono debe ser saturado, que tiene enlaces simples a tres átomos de otros. Una clase importante de alcoholes son los alcoholes acíclicos simples, la fórmula general para el cual es CnH2n +1 OH. De ellos, el etanol (C2H5OH) es el tipo de alcohol encontrado en bebidas alcohólicas, y en el lenguaje común la palabra alcohol se refiere específicamente al etanol.
Otros alcoholes son generalmente descritas con un adjetivo aclarar, como en alcohol isopropílico (propan-2-ol) o alcohol de madera (alcohol metílico, ormethanol). El sufijo-ol aparece en el nombre químico IUPAC de todas las sustancias donde el grupo hidroxilo es el grupo funcional con la más alta prioridad; sustancias en donde un grupo de prioridad más alta está presente el prefijo hidroxi-aparecerá en el nombre de la IUPAC. El sufijo-ol en los nombres no sistemáticos (como el paracetamol o el colesterol) también suele indicar que la sustancia incluye un grupo hidroxilo funcional y, así, se puede llamar un alcohol. Pero muchas sustancias, particularmente azúcares (glucosa y sacarosa ejemplos) contienen grupos funcionales hidroxilo sin utilizar el sufijo.

Hidrocarburos
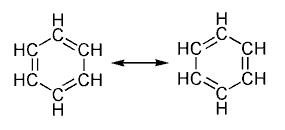
Un hidrocarburo aromático es un compuesto orgánico cíclico conjugado que cumple la Regla de Hückel, es decir, que tienen un total de 4n+2 electrones pi en el anillo. Para que se dé la aromaticidad, deben cumplirse ciertas premisas, por ejemplo que los dobles enlaces resonantes de la molécula estén conjugados y que se den al menos dos formas resonantes equivalentes. La estabilidad excepcional de estos compuestos y la explicación de la regla de Hückel han sido explicados cuánticamente, mediante el modelo de "partícula en un anillo".

Originalmente el término estaba restringido a un producto del alquitrán mineral, el benceno, y a sus derivados, pero en la actualidad incluye casi la mitad de todos los compuestos orgánicos; el resto son los llamados compuestos alifáticos.
El máximo exponente de la familia de los hidrocarburos aromáticos es el benceno (C6H6), pero existen otros ejemplos, como la familia deanulenos, hidrocarburos monocíclicos totalmente conjugados de fórmula general (CH)n.
A continuacion dejamos un enlace de un video acerca de la identificación de hidrocarburos:
lunes, 18 de junio de 2012
Alquinos
Los alquinos son hidrocarburos insaturados que contienen en su estructura cuando menos un triple enlace carbono-carbono.
La terminación sistémica de los alquinos es INO.
Los alquinos tienen unas propiedades físicas similares a los alcanos y alquenos. Son poco solubles en agua, tienen una baja densidad y presentan bajos puntos de ebullición. Sin embargo, los alquinos son más polares debido a la mayor atracción que ejerce un carbono sp sobre los electrones, comparado con un carbono sp3 o sp2.
Ejemplos de alquinos
El más importante de ellos es el acetileno utilizado en la elaboración de materiales como hule, cueros artificiales, plásticos etc. También se usa como combustible en el soplete oxiacetilénico en la soldadura y para cortar metales.
El propino se usa en soldaduras ya que es un gas incoloro, de olor característico, más denso que el aire y puede extenderse a ras del suelo.
Alquenos o alcenos
Los alquenos son compuestos insaturados que contienen en su estructura cuando menos un doble enlace carbono-carbono.
La terminación sistémica de los alquenos es ENO.
La mayor parte de los alquenos se obtienen del petróleo crudo y mediante la deshidrogenación de los alcanos.
Propiedades y usos
Sonrelativamente poco solubles en agua, pero solubles en ácido sulfúrico concentrado y en solventes no polares.
Su densidad, punto de fusión y de ebullición se elevan conforme aumenta el peso molecular.
El uso más importante de los alquenos es como materia prima para la elaboración de plásticos.
Ejemplos de alquenos
El etileno o eteno es un gas incoloro, insípido y de olor etéreo cuya fórmula es CH2=CH2. Se usan grandes cantidades de etileno (eteno) para la obtención del polietileno, que es un polímero. (sustancia formada por miles de moléculas más pequeñas que se conocen como monómeros). Por ejemplo del polietileno el monómero es el etileno. El polietileno es un compuesto utilizado en la fabricación de envolturas, recipiente, fibras, moldes, etc.
El etileno es utilizado en la maduración de frutos verdes como piñas y tomates.
En la antigüedad se utilizó como anestésico (mezclado con oxígeno) y en la fabricación del gas mostaza (utilizado como gas de combate).

Los alcanos o hidrocarburos
Los alcanos son hidrocarburos saturados, están formados exclusivamente por carbono e hidrógeno y únicamente hay enlaces sencillos en su estructura.
La terminación sistémica de los alcanos es ANO.
Nomenclatura de alcanos
1.- La base del nombre fundamental, es la cadena continua más larga de átomos de carbono.
2.- La numeración se inicia por el extremo más cercano a una ramificación.
3.- Si se encuentran dos o más cadenas con el mismo número de átomos de carbono, se selecciona la que deje fuera los radicales alquilo más sencillos.
4.- Cuando en un compuestos hay dos o más ramificaciones iguales,no se repite el nombre, se le añade un prefijo numeral.
Los prefijos numerales son:
Número
|
Prefijo
|
2
|
di
|
3
|
tri
|
4
|
tetra
|
5
|
penta
|
6
|
hexa
|
7
|
hepta
|
6.-Se escriben las ramificaciones en orden alfabético y el nombre del alcano que corresponda a la cadena principal, como una sola palabra junto con el último radical.
7.- Por convención, los números y las palabras se separan mediante un guión, y los números entre si, se separan por comas.
Radicales alquilo
Cuando alguno de los alcanos pierde un átomo de hidrógeno se forma un radical alquilo. Estos radicales aparecen como ramificaciones sustituyendo átomos de hidrógeno en las cadenas.
Los radicales alquilo de uso más común son:

Propiedades y usos de los alcanos
Son insolubles en agua
Pueden emplearse como disolventes para sustancias poco polares como grasas, aceites y ceras.
El gas de uso doméstico es una mezcla de alcanos, principalmente propano.
El gas de los encendedores es butano.El principal uso de los alcanos es como combustibles debido a la gran cantidad de calor que se libera en esta reacción.
Ejemplos de alcanos
 CH3CH2CH2CH3 (Butano)- La principal aplicación del gas butano (C4H10) es la del combustibleen hogares para la cocina y agua caliente, y en los mecheros de gas.
CH3CH2CH2CH3 (Butano)- La principal aplicación del gas butano (C4H10) es la del combustibleen hogares para la cocina y agua caliente, y en los mecheros de gas.
CH4(Metano)-mportante para la generación eléctrica ya que se emplea como combustible en las turbinas de gas o en generadores de vapor y también es utilizado en procesos químicos industriales y puede ser transportado como líquido refrigerado.
miércoles, 13 de junio de 2012
Introducción
Welcome!
Les damos la más cordial bienvenida a este blog el cual esta dedicado a explicar la química orgánica y sus usos.
Los seres vivos estamos formados por moléculas orgánicas, proteínas, ácidos nucleicos, azúcares y grasas. Todos ellos son compuestos cuya base principal es el carbono.
Los seres vivos estamos formados por moléculas orgánicas, proteínas, ácidos nucleicos, azúcares y grasas. Todos ellos son compuestos cuya base principal es el carbono.
Los productos orgánicos están presentes en todos los aspectos de nuestra vida: la ropa que vestimos, los jabones,shampoos, desodorantes, medicinas, perfumes, utensilios de cocina, la comida, etc.
La química orgánica área de la química que estudia la reactividad y las propiedades de las moléculas constituidas principalmente por átomos de carbono.
Hay una serie de elementos que forman parte principalmente de estos compuestos: Carbono (C), Hidrógeno (H), Oxígeno (O), Nitrógeno (N).
El carbono (C) tiene 4 electrones en la capa de valencia. Por lo tanto va a formar siempre 4 enlaces covalentes;los enlaces pueden ser: simples (alcanos), dobles (alquenos) y triples (alquinos).
Los productos orgánicos han mejorado nuestra calidad y esperanza de vida.
Un buen ejemplo de familia de compuestos que a casi a todos nos ha salvado la vida, los antibióticos.
Los compuestos orgánicos presentan una enorme variedad de propiedades y aplicaciones y son la base de numerosos compuestos básicos en nuestras vidad pero así como los usamos diario debemos de saber de donde provienen.
Suscribirse a:
Entradas (Atom)






